Läs mer
Vår forskning: Lars-Gunnar Larssons forskargrupp
Vår forskning fokuserar på onkproteinet MYC:s funktion och reglering. Vårt mål är att utnyttja denna kunskap för att hitta vägar att direkt eller indirekt hämma MYC i tumörceller.
Våra projekt
MYC är modifierad på flera ställen genom t.ex. fosforylering, acetylering och ubiquitylering, och dessa modifieringar påverkar MYC:s funktion, inklusive dess interaktion med hjälpfaktorer liksom dess snabba omsättning via ubiquitin/proteasom-systemet. Vi försöker utreda vilken funktionell roll dessa modifieringar och interaktioner spelar, och hur de påverkar MYC-driven tumörutveckling.
Det har blivit klarlagt att MYC interagerar med hundratals proteiner i cellkärnan, och dessa interaktioner påverkar troligen MYC:s funktion and aktivitet, t.ex. med avseende på reglering av kromatinstruktur, olika faser av transkriptionscykeln, RNA-processning, DNA-reparation, replikation och andra funktioner. Men detta har bara undersökts för en handfull av interaktioner, och vi är speciellt intresserade av vilken roll interaktioner med kinaser och dess inhibitorer, såsom CDK2 and p27, kromatin-modifierare som EZH2, BMI1 och SIRT1, liksom E3-ubiquitinligaser som SKP2, FBXW7 and FBXO28 spelar för MYC:s biologi. Vi har evidens att även andra E3-ligaser deltar i ubiquitylering av MYC, och vi undersöker vilken specifik roll var och en av dessa spelar och deras relation till varandra.
För att studera och möjligen interferera med MYC/hjälpfaktor-interaktioner, har vi etablerat flera cellbaserade protein/protein-interaktions-assays, såsom bimolekylär fluorescens-kompletterings-assay (BiFC), splittad Gaussia luciferas-assay (GLuc), in situ Proximity Ligation Assay (isPLA), där sådana interaktioner kan visualiseras i levande eller fixerade celler och vävnader.
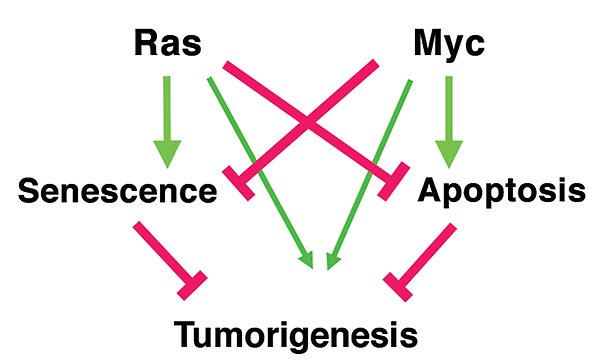
Samarbete mellan MYC och RAS under tumörutveckling.
MYC:s roll under tumörutveckling
MYC är involverad i många cellulära processer, men vi har under senare år blivit intresserade av MYC:s roll i reglering av cellulär senescens, som är en av de viktigaste skyddsmurarna mot tumörutveckling. Vi fann att MYC undertrycker senescens inducerad av onkgener såsom RAS och BRAF, och att detta är en viktig del av samarbetet mellan MYC och dessa faktorer vid onkogen transformation. Vidare fann vi att cellcykelkinaset CDK2 spelar en viktig roll i MYC-medierad suppression av senescens, och att detta kräver fosforylering av MYC på Ser-62 via CDK2. Inhibition av CDK2 med små molekylära inhibitorer inducerade också senescens i MYC-drivna tumörceller i kultur och in vivo i mustumörmodeller.
För att studera hur viktigt senescens-suppression är för tumörutveckling in vivo har vi etablerat konditionella, transgena, immunokompetenta lung- och melanom-tumörmodeller i möss drivna av MYC och BRAFV600E, samt även musmodeller för akut myeloid leukemi (AML) driven av MYC och BCL-XL och för MYCN-drivna neuroblastom. Vi studerar t.ex. vilken inverkan CDK2 depletion/inhibition har på senescens och tumörutveckling i dessa modeller för potentiell “pro-senescens-terapi”.
En viktig aspekt av det senescenta tillståndet i celler är den senescens-associerade sekretoriska fenotypen (SASP), som involverar produktion och sekretion av cytokiner och kemokiner som kommunicerar med både det adaptiva och det medfödda immunsystemet med syftet att eliminera senescenta celler. Vi använder för närvarande lungtumör-, melanom- och neuroblastom-modellsystemen för att dissekera interaktionerna mellan senescenta tumörceller och immunceller med målet att utforska potentiella synergier mellan pro-senescens- och immun-terapier för cancerbehandling.
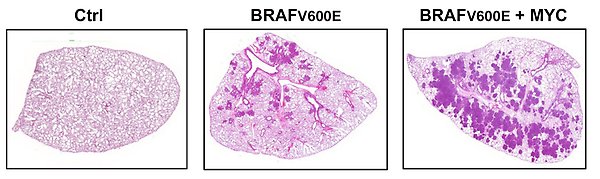
MYC accelererar BRAFV600E-driven lungtumörutveckling i möss.
Målinriktad inaktivering av MYC
Trots det omedelbara behovet att målinriktat inaktivera MYC i cancer har MYC ansetts “icke-drogbart (undrubbable)” på grund av sin inneboende oordnade struktur och avsaknad av enzymatisk aktivitet, och av denna anledning finns det inga specifika MYC-hämmare i kliniskt bruk för cancerbehandling för närvarande. Det finns flera olika sätt att potentiellt hämma MYC direkt eller indirekt. Som nämndes ovan är MYC beroende av interaktioner med olika hjälpfaktorer. Vi har identifierat och karakteriserat flera potenta och selektiva små molekylära inhibitorer av interaktionen mellan MYC och dess obligatoriska hjälpfaktor MAX. Dessa molekyler binder direkt till MYC och inhiberar MYC-beroende genreglering, tumörcell-tillväxt och tumörutveckling in vivo i musmodeller, men dödar inte normala celler. Förbättrade varianter av dessa molekyler är just nu under utveckling. De protein-interaktions-assay-system vi har utvecklat kan också användas till att identifiera inhibitorer till andra MYC/hjälpfaktor-interaktioner. Det långsiktiga målet med detta arbete är att utveckla kliniskt verksamma nya läkemedel för cancerbehandling.
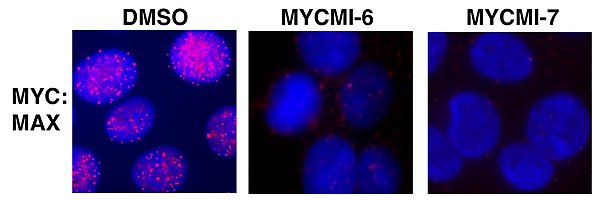
Inhibition av MYC/MAX-interaktion i celler med de små molekylerna MYCMI-6 och MYCMI-7 såsom visualiserat med hjälp av isPLA
