Forskningsprojekt i Widerstens grupp
Vårt moderna samhälle vore otänkbart utan ständig utveckling och framställning av nya kemikalier. Dessa är oundgängliga byggstenar i våra material, läkemedel, som bränsle till våra fordon samt inom forskning och utveckling. Produktion av kemikalier har traditionellt varit, och är fortfarande, nästan helt beroende av tillgången på oljebaserade råmaterial. Dessutom används ofta sällsynta övergångsmetaller som katalysatorer i syntesen och det skapas stora mängder avfall som i många fall kräver särskild hantering på grund av dess giftighet.
Ett viktigt steg mot mer miljövänlig produktion av nödvändiga kemikalier vore att förändra syntesvägarna mot långsiktigt hållbara tekniker. Naturens egna katalysatorer, enzymer, har länge varit mycket eftertraktade för användning vid kemikalieframställning då de skulle medföra flera fördelar jämfört med traditionella syntesmetoder. Mängden farligt avfall skulle kunna minskas drastiskt då enzymer är biologiskt nedbrytbara, arbetar i vattenlösning och eliminerar behovet av sällsynta övergångsmetaller. Detsamma gäller energikonsumtionen eftersom enzym arbetar effektivt i rumstemperatur till skillnad från traditionella katalysatorer som ofta kräver uppvärmning av reaktionsblandningen. Dessutom karaktäriseras enzymer av en oöverträffad effektivitet och selektivitet. Ofta kan enzymer särskilja olika stereoisomerer av samma molekyl och acceptera endast den ena isomeren som substrat, vilket gör dem mycket attraktiva som katalysatorer för kiral syntes där produktrenhet är avgörande.
I vår forskning studerar vi en rad olika enzymer i syfte att förstå vilka egenskaper som gör dem till effektiva kemiska katalysatorer. Denna kartläggning är viktig då den nya kunskapen gör det möjligt att utveckla helt nya enzymvarianter med specialanpassade egenskaper. Nya enzymvarianter åstadkoms genom en process som benämns riktad evolution. Gener som kodar för enzymerna förändras i en kontrollerad process vilket resulterar i nya enzymvarianter som bär olika förändringar i sina aktiva säten där den kemiska reaktionen äger rum och katalyseras. I processen bildas en mängd olika enzymvarianter, alla med mer eller mindre förändrade egenskaper. Ur dessa bibliotek av förändrade enzym sållar vi fram de varianter som uppvisar egenskaper i riktning mot de önskade, alltså förbättrade versioner av utgångsenzymet som till exempel skulle kunna användas för storskalig produktion av industriellt relevanta kemikalier. Ett av våra mål är att konstruera flerstegsreaktioner där samtliga reaktionssteg är enzymkatalyserade.
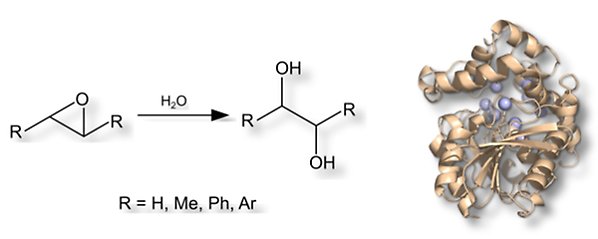
Epoxidhydrolas
Epoxidhydrolaset StEH1 från potatis har visat sig vara en mycket lovande enzymkatalysator för hydrolys av epoxider. Enzymet är stereoselektivt, lätt att producera, strukturellt stabilt även efter mutagenes och vi har samlat in mycket struktur/aktivitetsdata under de senare åren. Vi studerar detta enzym och laboratorieutvecklade enzymvarianter genom en kombination av funktions- och strukturanalyser samt beräkningskemiska metoder. Målet är att isolera nya stereoselektiva enzymer som är lämpliga som biokatalysatorer.
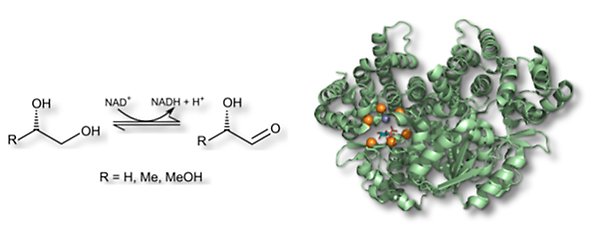
Alkoholdehydrogenas
Propandiol oxidoreduktas (FucO), från Escherichia coli, är ett dioldehydrogenas som katalyserar oxidation av korta alifatiska alkoholer såsom 1,2-propandiol till motsvarande aldehyd. Enzymet är regioselektivt (reagerar endast med primära alkoholer) och enantioselektivt. FucO tillhör grupp III av alkoholdehydrogenaser vilka är beroende av en järn(III)-jon för sin aktivitet. Enzymets struktur är anpassad till att tillåta bindning av lågmolekylära föreningar som det fysiologiska substratet S-1,2-propandiol. Genom mutagenes och riktad evolution vill vi vidga substratselektiviteten till att innefatta även större alkoholer, till exempel aromatiska dioler.
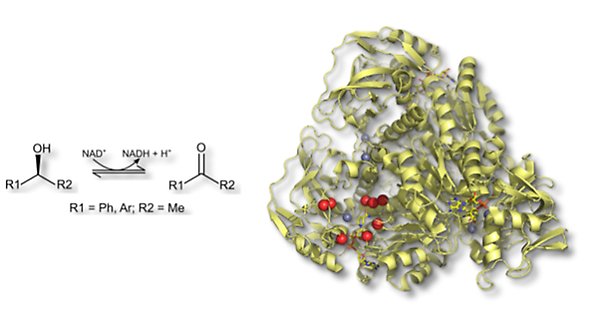
Alkoholdehydrogenaset från Rhodococcus ruber DSM 44541, ADH-A, katalyserar oxidation av sekundära alkoholer till motsvarande ketoner. ADH-A är ett NAD+/NADH och zink-beroende alkoholdehydrogenas, vars struktur är närbesläktad med tidigare välkaraktäriserade isoenzymer från hästlever och jäst. ADH-A uppvisar god aktivitet med fenyl-substituerade sekundära alkoholer men relativt sett låg aktivitet med vicinala dioler. Den låga diolaktiviteten gör det intressant att genom mutagenes och riktad evolution isolera ADH-A-varianter som uppvisar god aktivitet även med aryl-substituerade dioler.
Aldolas
Aldolreaktioner utgör en grundpelare inom organisk synteskemi då de möjliggör bildandet av nya kol-kol bindningar samtidigt som nya stereocenter bildas. Aldolreaktioner utnyttjas vid syntes av en rad olika hydroxylerade föreningar. Dessa är av speciellt intresse vid syntes av bioaktiva ämnen och kan bildas från α-hydroxylerade ketoner och aldehyder. Vi studerar bland annat 2'-deoxy-5-fosfat-ribosaldolas (DERA) och fruktos-6-fosfataldolas (FSA) från E. coli med fokus på ökad förståelse av kinetiska mekanismer samt evolution av nya substratpreferenser. Målet är att bredda substratselektiviteten till att även innefatta icke-fosforylerade substrat, till exempel aryl-substituerade aldehyder.
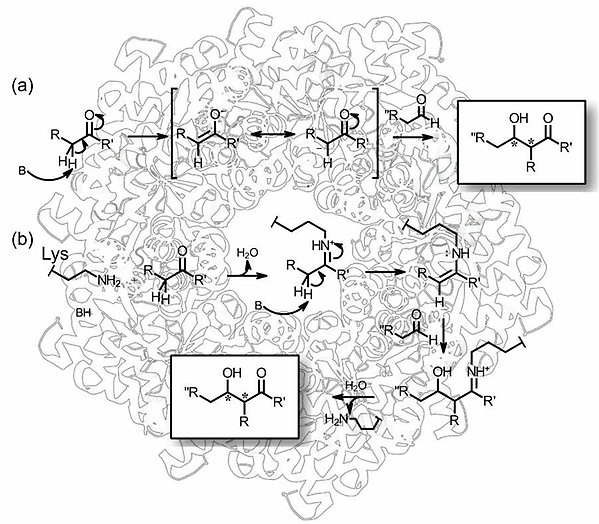
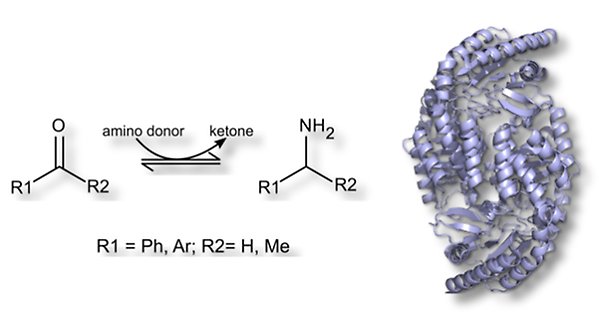
Aminotransferas
Amin:pyruvat aminotransferas från Vibrio fluvialis JS17, APA, katalyserar PLP-beroende överföring av aminogrupper från aminer och aminosyror till α-ketosyror, aldehyder och ketoner. APA uppvisar viss aktivitet med fenyl-substituerande substrat, dock lägre med större aminacceptorer. Det gör det intressant att studera APAs aktivitet med ketoner med olika substituenter och att introducera mutationer för att öka APAs aktivitet med större acceptorer samt med α-hydroxyketoner (acyloiner). Målet är att isolera nya APA varianter som stereoselektivt katalyserar aminogruppsöverföring till arylsubstituerade och hydroxylerade aminoacceptorer.