Karin Forsberg Nilsson – Mekanismer för uppkomst och spridning av hjärntumörer
Vi forskar om hjärntumörer för att hitta nya behandlingar.
När stamceller i hjärnan får genskador (mutationer) kan det orska onormal celltillväxt och leda till tumörer. Glioblastom (GBM) är den vanligaste formen av elakartad hjärntumör hos vuxna, med mycket dåligt prognos. Hos barn är medulloblastom (MB) den vanligaste elakartade hjärntumören och även om prognosen har blivit bättre kan inte alla botas.
Framsteg inom forskningen ligger till grund för all behandling av cancer. För att fler patienter ska botas och färre behöva leva med biverkningar av den behandling de genomgått, krävs grundforskning och patientnära forskning i nära samverkan. Drivkraften bakom vår forskning är att den kunskap vi tar fram ska omvandlas till behandlingsmöjligheter. Våra forskningsprojekt är grundforskningsprojekt som har klinisk anknytning genom att vi samverkar med kliniska kompetenser och baserar många studier på kliniska material från biobanker och patientdata.
Målet med vår forskning är att våra resultat ska kunna användas för att stoppa hjärntumörcellers tillväxt och spridning. Forskningsresultaten hjälper också till att förstå hur hjärntumörer uppkommer.
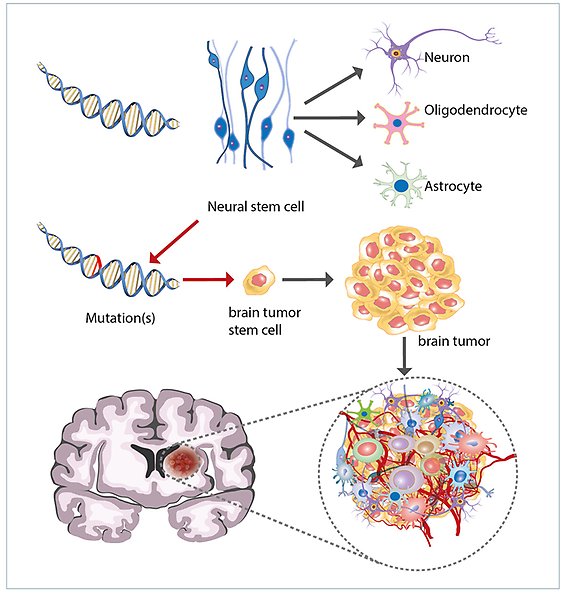
Mutationer i hjärnans stamceller kan ge upphov till hjärntumörer. Stamceller i hjärnan mognar normalt till nervceller, astrocyter och oligodendrocyter. Om mutationer som leder till felaktig tillväxtkontroll ansamlas i stamcellerna kan det leda till uppkomst av hjärntumörer.
Hjärntumörer drivs av många mutationer
De genetiska förändringarna i hjärntumörer är inte helt kartlagda och vår forskning går ut på att hitta genvarianter som driver tumöruppkomst eller progression. Vi har tagit fram en ny metod för att hitta mutationer i hjärntumörer. Många studier har utforskat de 1.5% procent av människans DNA som ger upphov till proteiner, men mindre är känt om resten av arvsmassan. I cancer uppstår alltså 98% av mutationerna i de delar som är minst studerade och att skilja de mutationer som driver cancern från de som saknar betydelse är svårt. För att få en heltäckande bild av vilka mutationer som är viktiga har vi specifikt letat efter konserverade positioner i arvsmassan.
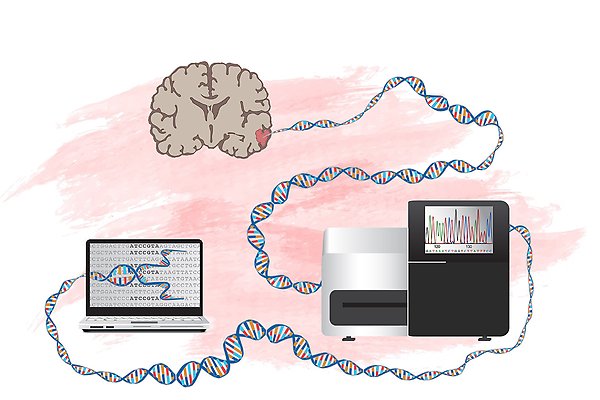
Helgenomsekvensning av elakartade hjärntumörer. Vi sekvensar hela cancergenomet hos hjärntumörpatiener och jämför tumörens arvsmassa med den från patientens normala celler. På så sätt kan vi kartlägga alla mutationer i tumören och sålla fram de som är viktiga för sjukdomen. Grafik: L Gaffney.
Hypotesen är att DNA-sekvenser som i däggdjur förblivit oförändrade genom miljontals år av evolution har viktiga funktioner. Vi samkör mutationer från patienter med MB eller GBM med informationen om hur väl varje enskild position i arvsmassan bevarats. Mutationer i positioner som knappt förändrats antas ha störst betydelse. Därmed kan vi sortera fram de viktigaste mutationerna på ett sätt som annars inte vore möjligt, för att i nästa steg testa deras funktion. Vi har kunnat visa att mutationer vi sållat fram påverkar odlade cancercellers tillväxt och motståndskraft mot läkemedel. Det nya sättet att analysera mutationer skulle därmed kunna ge indikationer på individanpassade läkemedel, s.k. precisionsmedicin.
Cancerforskning behöver relevanta cellmodeller och tillsammans med andra forskargrupper i forskningsprogrammet Neuroonkologi och neurodegeneration har vi skapat en storskalig cellbank av mycket välkarakteriserade cancerstamceller från GBM-patienter som donerat tumörvävnad (www.hgcc.se).
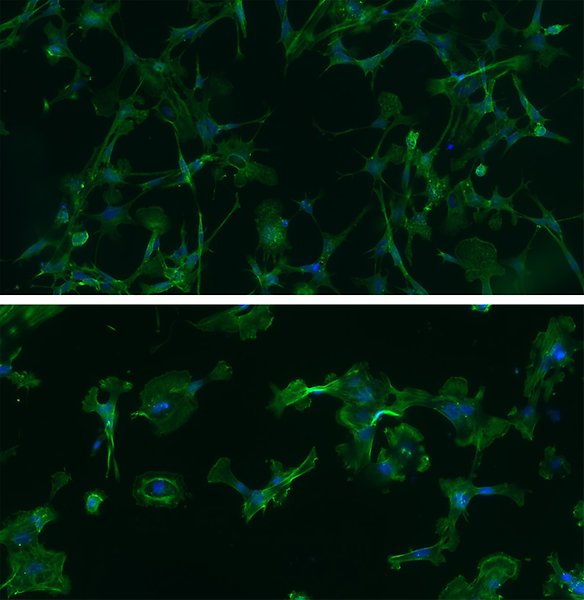
Exempel på GBM-celler från patienters tumörer odlade under samma förhållanden som stamceller från hjärnan. Dessa celler bibehåller viktiga egenskaper från tumören och gör dem till utmärkta modeller för att studera sjukdomen. Cellernas cytoskelett (aktin) har färgats grönt med phalloidin och cellkärnorna är blå (DAPI-färg). Foto: G Wicher
Tumörmikromiljön i hjärntumörer
Ett stort kliniskt problem är hjärntumörcellers invasivitet, det vill säga att de tränger in i omkringliggande normal hjärnvävnad. Om vi bättre förstår hur tumörcellerna infiltrerar hjärnan kan vi hitta vägar att stoppa det. Sammansättningen av molekyler runt cellerna i vår hjärna består till stor del av proteoglykaner (proteiner med påkopplade kolhydratkedjor). Omsättningen av dessa regleras av komplicerade biokemiska processer som innefattar många enzymatiska steg.
Vi undersöker hur en störd balans mellan uppbyggnad och nedbrytning av proteoglykaner kan påverka cancerns tillväxt. Vi har funnit att ett enzym som bryter ner proteoglykaner är av stor betydelse för hjärntumörers aggressivitet. Vi utvecklar nu detta fynd i cancercellkulturer från hjärntumörer och i musmodeller, i syfte att verifiera om detta enzym är ett tänkbar terapeutiskt mål för cancerbehandling.
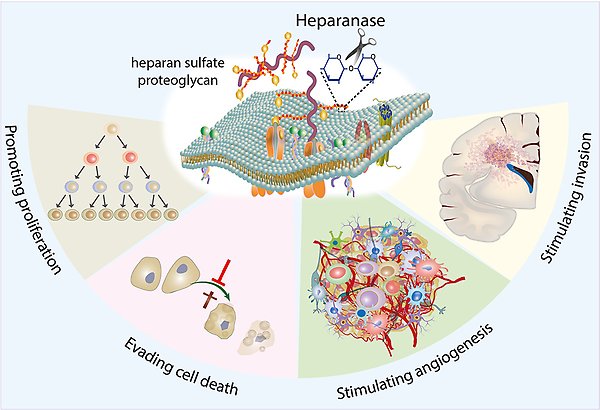
Överuttryck av heparanase, enzymet som bryter ner heparansulfatproteoglykaner, aktiverar flera signalvägar av betydelse för tumörtillväxt och tumörprogression. Heparanase gör så att hjärntumörceller tillväxer snabbare, det motverkar celldöd, ökar blodkärlsinväxten i tumören, samt stimulerar cancercellers motilitet och invasiva förmåga.
Tumör-driven inflammation i hjärnan
Ett annat problem med dessa tumörer är infiltration av immunceller i tumörmikromiljön vilket bidrar till tumörtillväxten och cancerns motståndskraft mot behandling. Elakartade hjärntumörer kan genom sitt snabba växtsätt betraktas som skador i hjärnan. Tumör-driven neuroinflammation bidrar till resistens mot cancerläkemedel och vi studerar därför hjärnans inflammatoriska svar på cancer.
Vår hypotes är att den syrefattiga miljön runt en växande cancer uppfattas som en vävnadsskada vilket utlöser försvarsmekanismer. Vi undersöker om ämnen som vi tidigare funnit påverkar inflammation i hjärnan vid hjärnskada, också kan vara verksamma i GBM. Den kunskapen skulle i så fall kunna användas för att förhindra tumören drar nytta av inflammatoriska processer.
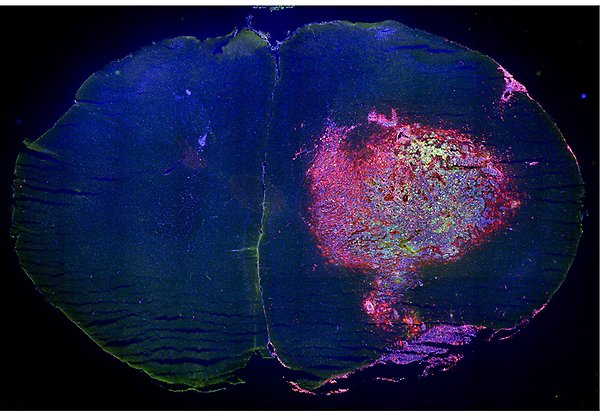
Hjärntumörer infiltreras av immunceller. Bilden visar en mushjärna med hjärntumör (gliom) i den ena hjärnhalvan. Två typer av immunceller, mikroglia och makrofager (röd färg för CD11b) har infiltrerat tumören som visas med grönt (green fluorescent protein) Cellkärnor är färgade blå (DAPI) för att ge en överskådlig bild av tumörens omgvining. Foto: G Wicher.
Publikationer
Ingår i Acta neuropathologica communications, 2024
- DOI för Decoding of the surfaceome and endocytome in primary glioblastoma cells identifies potential target antigens in the hypoxic tumor niche
- Ladda ner fulltext (pdf) av Decoding of the surfaceome and endocytome in primary glioblastoma cells identifies potential target antigens in the hypoxic tumor niche
Leveraging base-pair mammalian constraint to understand genetic variation and human disease
Ingår i Science, s. 367-+, 2023
Live Detection of Neural Progenitors and Glioblastoma Cells by an Oligothiophene Derivative
Ingår i ACS Applied Bio Materials, s. 3790-3797, 2023
- DOI för Live Detection of Neural Progenitors and Glioblastoma Cells by an Oligothiophene Derivative
- Ladda ner fulltext (pdf) av Live Detection of Neural Progenitors and Glioblastoma Cells by an Oligothiophene Derivative
Using evolutionary constraint to define novel candidate driver genes in medulloblastoma
Ingår i Proceedings of the National Academy of Sciences of the United States of America, 2023
- DOI för Using evolutionary constraint to define novel candidate driver genes in medulloblastoma
- Ladda ner fulltext (pdf) av Using evolutionary constraint to define novel candidate driver genes in medulloblastoma
Ingår i Proceedings of the National Academy of Sciences of the United States of America, 2022
PTEN inhibits AMPK to control collective migration
Ingår i Nature Communications, 2022
- DOI för PTEN inhibits AMPK to control collective migration
- Ladda ner fulltext (pdf) av PTEN inhibits AMPK to control collective migration
Ingår i Molecular Cancer Research, s. 528-540, 2021
Involvement of Heparan Sulfate and Heparanase in Neural Development and Pathogenesis of Brain Tumors
Ingår i Heparanase, s. 365-403, Springer, 2020
Ingår i Cancers, 2020
- DOI för Nuclear Receptor Binding Protein 2 Is Downregulated in Medulloblastoma, and Reduces Tumor Cell Survival upon Overexpression
- Ladda ner fulltext (pdf) av Nuclear Receptor Binding Protein 2 Is Downregulated in Medulloblastoma, and Reduces Tumor Cell Survival upon Overexpression
Ingår i Genome Biology, 2020
- DOI för Whole-genome sequencing of glioblastoma reveals enrichment of non-coding constraint mutations in known and novel genes
- Ladda ner fulltext (pdf) av Whole-genome sequencing of glioblastoma reveals enrichment of non-coding constraint mutations in known and novel genes
ADAMDEC1 Maintains a Growth Factor Signaling Loop in Cancer Stem Cells
Ingår i Cancer Discovery, s. 1574-1589, 2019
BET and Aurora Kinase A inhibitors synergize against MYCN-positive human glioblastoma cells
Ingår i Cell Death and Disease, 2019
- DOI för BET and Aurora Kinase A inhibitors synergize against MYCN-positive human glioblastoma cells
- Ladda ner fulltext (pdf) av BET and Aurora Kinase A inhibitors synergize against MYCN-positive human glioblastoma cells
Heparanase promotes glioma progression via enhancing CD24 expression
Ingår i International Journal of Cancer, s. 1596-1608, 2019
Ingår i Oncoimmunology, 2019
- DOI för Human Mesenchymal glioblastomas are characterized by an increased immune cell presence compared to Proneural and Classical tumors
- Ladda ner fulltext (pdf) av Human Mesenchymal glioblastomas are characterized by an increased immune cell presence compared to Proneural and Classical tumors
Ingår i Cancers, 2019
- DOI för Integrin alpha 10, a Novel Therapeutic Target in Glioblastoma, Regulates Cell Migration, Proliferation, and Survival
- Ladda ner fulltext (pdf) av Integrin alpha 10, a Novel Therapeutic Target in Glioblastoma, Regulates Cell Migration, Proliferation, and Survival
Proteomic approach for understanding milder neurotoxicity of Carfilzomib against Bortezomib
Ingår i Scientific Reports, 2018
- DOI för Proteomic approach for understanding milder neurotoxicity of Carfilzomib against Bortezomib
- Ladda ner fulltext (pdf) av Proteomic approach for understanding milder neurotoxicity of Carfilzomib against Bortezomib
Reprint of: A chemical screen identifies trifluoperazine as an inhibitor of glioblastoma growth
Ingår i Biochemical and Biophysical Research Communications - BBRC, s. 136-142, 2018
A chemical screen identifies trifluoperazine as an inhibitor of glioblastoma growth
Ingår i Biochemical and Biophysical Research Communications - BBRC, s. 477-483, 2017
Ingår i Matrix Biology, s. 92-104, 2017
Ingår i Molecular Cancer Therapeutics, s. 1705-1716, 2017
Interleukin-33 Promotes Recruitment of Microglia/Macrophages in Response to Traumatic Brain Injury
Ingår i Journal of Neurotrauma, s. 3173-3182, 2017
Ingår i Scientific Reports, 2016
- DOI för ABCG2 regulates self-renewal and stem cell marker expression but not tumorigenicity or radiation resistance of glioma cells
- Ladda ner fulltext (pdf) av ABCG2 regulates self-renewal and stem cell marker expression but not tumorigenicity or radiation resistance of glioma cells
Case-specific potentiation of glioblastoma drugs by pterostilbene
Ingår i Oncotarget, s. 73200-73215, 2016
Heparanase Promotes Glioma Progression and is Inversely Correlated with Patient Survival.
Ingår i Molecular Cancer Research, s. 1243-1253, 2016
Open for collaboration: an academic platform for drug discovery and development at SciLifeLab
Ingår i Drug Discovery Today, s. 1690-1698, 2016
- DOI för Open for collaboration: an academic platform for drug discovery and development at SciLifeLab
- Ladda ner fulltext (pdf) av Open for collaboration: an academic platform for drug discovery and development at SciLifeLab
Ingår i The European Physical Journal Plus, 2016
Ingår i PLOS Genetics, 2016
- DOI för Utilizing the Dog Genome in the Search for Novel Candidate Genes Involved in Glioma Development-Genome Wide Association Mapping followed by Targeted Massive Parallel Sequencing Identifies a Strongly Associated Locus
- Ladda ner fulltext (pdf) av Utilizing the Dog Genome in the Search for Novel Candidate Genes Involved in Glioma Development-Genome Wide Association Mapping followed by Targeted Massive Parallel Sequencing Identifies a Strongly Associated Locus
Ingår i European Journal of Pharmacology, s. 101-107, 2015
Ingår i Oncotarget, s. 23647-23661, 2015
- DOI för Glioma-derived plasminogen activator inhibitor-1 (PAI-1) regulates the recruitment of LRP1 positive mast cells
- Ladda ner fulltext (pdf) av Glioma-derived plasminogen activator inhibitor-1 (PAI-1) regulates the recruitment of LRP1 positive mast cells
Ingår i Science Signaling, 2015
Ingår i EBioMedicine, s. 1351-1363, 2015
- DOI för The Human Glioblastoma Cell Culture Resource: Validated Cell Models Representing All Molecular Subtypes
- Ladda ner fulltext (pdf) av The Human Glioblastoma Cell Culture Resource: Validated Cell Models Representing All Molecular Subtypes
Ingår i Biochimica et Biophysica Acta - General Subjects, s. 2526-2532, 2014
Ingår i Acta Physiologica, s. 100-100, 2014
Ingår i Molecular Oncology, s. 50-58, 2014
Glycosaminoglycans and Glioma Invasion
Ingår i European Association of NeuroOncology Magazine, s. 75-80, 2014
Heparan sulfate in the regulation of neural differentiation and glioma development
Ingår i The FEBS Journal, s. 4993-5008, 2014
Rabbit genome analysis reveals a polygenic basis for phenotypic change during domestication
Ingår i Science, s. 1074-1079, 2014
Selective Calcium Sensitivity in Immature Glioma Cancer Stem Cells
Ingår i PLOS ONE, 2014
- DOI för Selective Calcium Sensitivity in Immature Glioma Cancer Stem Cells
- Ladda ner fulltext (pdf) av Selective Calcium Sensitivity in Immature Glioma Cancer Stem Cells
Ingår i Cell, s. 313-328, 2014
Ingår i PLOS ONE, 2013
- DOI för Adenovirus Serotype 5 Vectors with Tat-PTD Modified Hexon and Serotype 35 Fiber Show Greatly Enhanced Transduction Capacity of Primary Cell Cultures
- Ladda ner fulltext (pdf) av Adenovirus Serotype 5 Vectors with Tat-PTD Modified Hexon and Serotype 35 Fiber Show Greatly Enhanced Transduction Capacity of Primary Cell Cultures
Ingår i Neuro-Oncology, s. 1469-1478, 2013
Developmental expression of IL-33 in the mouse brain
Ingår i Neuroscience Letters, s. 171-176, 2013
Interleukin-33 in brain development and traumatic brain injury
Ingår i Glia, 2013
Intraperitoneal influx of neutrophils in response to IL-33 is mast cell-dependent
Ingår i Blood, s. 530-536, 2013
Common Denominators of Self-renewal and Malignancy in Neural Stem Cells and Glioma
Ingår i Stem Cells and Human Disease, s. 387-418, Springer Netherlands, 2012
Ingår i Restorative Neurology and Neuroscience, s. 9-19, 2012
Neural stem cells: Brain building blocks and beyond
Ingår i Upsala Journal of Medical Sciences, s. 132-142, 2012
Ingår i PLOS ONE, 2012
- DOI för Platelet-derived growth factor over-expression in retinal progenitors results in abnormal retinal vessel formation
- Ladda ner fulltext (pdf) av Platelet-derived growth factor over-expression in retinal progenitors results in abnormal retinal vessel formation
Undersulfation of Heparan Sulfate Restricts Differentiation Potential of Mouse Embryonic Stem Cells
Ingår i Journal of Biological Chemistry, s. 10853-10862, 2012
Ingår i Journal of Biological Chemistry, s. 24189-24199, 2011
Ingår i Experimental Cell Research, s. 2779-2789, 2010
2009
Grafted neural progenitors migrate and form neurons after experimental traumatic brain injury
Ingår i Restorative Neurology and Neuroscience, s. 323-334, 2009
Environmental cues from CNS, PNS, and ENS cells regulate CNS progenitor differentiation
Ingår i NeuroReport, s. 1283-9, 2008
Ingår i Molecular and Cellular Neuroscience, s. 32-9, 2008
Stamceller i centrala nervsystemet - Balans mellan tumörutveckling och regeneration
Ingår i Onkologi i Sverige, s. 29-34, 2008
An activating mutation in the PDGF receptor-beta causes abnormal morphology in the mouse placenta
Ingår i International Journal of Developmental Biology, s. 361-370, 2007
Enhanced neuronal differentiation in a three-dimensional collagen-hyaluronan matrix
Ingår i Journal of Neuroscience Research, s. 2138-2146, 2007
Ingår i Journal of Applied Polymer Science, s. 60-70, 2007
Ingår i American Journal of Hypertension, s. 743-750, 2007
Ingår i Developmental Dynamics, s. 2485-2492, 2007
Ingår i Cancer Research, s. 8042-8048, 2006
Ingår i NeuroReport, s. 623-628, 2006
Ingår i Growth Factors, s. 184-196, 2006
Gli1 is not required for Pdgfralpha expression during mouse embryonic development
Ingår i Differentiation, s. 109-19, 2005
Semicarbazide-sensitive amine oxidase in transgenic mice with diabetes
Ingår i Biochemical and Biophysical Research Communications - BBRC, s. 1013-1020, 2004
Stem cell factor is a chemoattractant and a survival factor for CNS stem cells
Ingår i Experimental Cell Research, s. 201-210, 2004
Ingår i Glia, s. 276-89, 2003
Ingår i Molecular Cancer Research, s. 147-154, 2002
Immature neurons from CNS stem cells proliferate in response toplatelet-derived growth factor
Ingår i Journal of Neuroscience, s. 3483-3491, 2001
Platelet-derived growth factor induces chemotaxis of neuroepithelial stem cells
Ingår i Journal of Neuroscience Research, s. 521-530, 1998
Ingår i Mechanisms of Development, s. 167-180, 1998
Human mast cells express functional TrkA and are a source of nerve growth factor
Ingår i European Journal of Immunology, s. 2295-2301, 1997
Development of neuronal precursor cells from embryonic stem cells in vitro
Ingår i Mechanisms of Development, s. 89-102, 1996
Ingår i Scandinavian Journal of Immunology, s. 267-272, 1996
Luteal failure in transgenic mice carrying a PDGF dominant-negative mutant/GH hybrid transgene
Ingår i Transgenics (Basel. Print), s. 515-523, 1995
A divergent effect of PDGF-AA and -BB on differentiating neural stem and progenitor cells
Targeting SOX2 in glioblastoma cells reveals heterogeneity in SOX2 dependency

