Fredrik Palm
Njurfysiologi och njursjukdom
Njursjukdom är en viktig orsak till förtidig död. På senare tid har fokus flyttats från en glomerulocentrisk till en övervägande tubulocentrisk syn på mekanismer som är involverade i utvecklingen av njursjukdom orsakad av diabetes, högt blodtryck eller akut njurskada (Vallon och Thomson 2012). Vårt forskningsprogram fokuserar på bättre förståelse av grundläggande njurfysiologi och patologiska mekanismer som leder till njursjukdom. Nyligen har vi riktat betydande ansträngningar för att avgränsa involveringen av störd intrarenal syrehomeostas för uppkomsten och progressionen av akut och kronisk njursjukdom.
Syrenivån i njurvävnaden är låg redan under normala förhållanden (Aukland och Krog 1960, Leichtweiss et al 1969) och försök att öka syretillförseln via ökat njurblodflöde resulterar normalt också i ökad tubulär belastning av elektrolyter på grund av förhöjd glomerulär filtrationshastighet, vilket i sig ökar den metaboliska efterfrågan. Varje ökning av njurmetabolismen kommer således sannolikt att resultera i minskad syretillgång i njurvävnaden, dvs hypoxi. I själva verket är ökad njurmetabolism associerad med diabetesnefropati (Korner et al 1994) och diabetes är associerad med en minskad syretillgång i njurvävnaden hos både djur och patienter (Ries et al 2003, dos Santos et al 2007, Rosenberger et al 2008, Edlund et al 2009, Haidara et al. 2009, Inoue et al. 2011). Fine et al. föreslagit att en initial glomerulär skada minskar blodflödet genom peritubulära kapillärer och resulterar i minskad syresättning av njuren, vilket främjar tubulointerstitiell fibros och progression till njurskada (Fine, Orphanides et al 1998). Viktigt är att kronisk tubulointerstitiell hypoxi har föreslagits som en möjlig väg till njursjukdom, oavsett initial orsak (Nangaku 2004, Nangaku 2006, Singh et al 2008, Mimura och Nangaku 2010, Palm och Nordquist 2011).
2003 presenterade vi vår första rapport som visar intrarenal vävnadshypoxi vid diabetes (Palm et al. 2003), som därefter har verifierats av flera internationella laboratorier (Ries et al 2003, dos Santos et al 2007, Rosenberger et al 2008, Yin et al 2012). Sedan dess har vi fortsatt att undersöka vilken roll intrarenal vävnadshypoxi har för utvecklingen av diabetesnefropati, men även under andra tillstånd associerade med ökad risk för njursjukdom, såsom högt blodtryck, ischemi-reperfusionsskada och kirurgisk 5/6 nefrektomi.
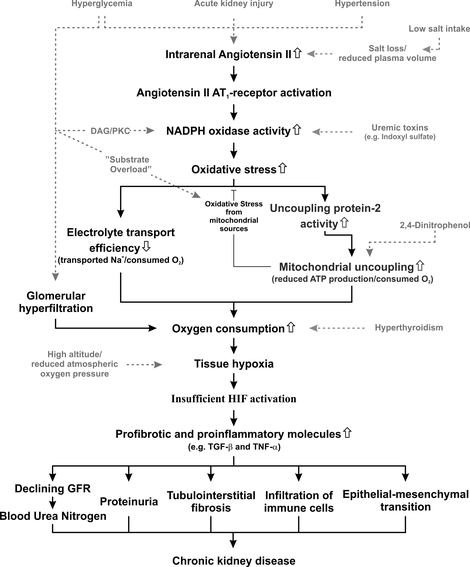
Övergripande hypotes för forskagruppens aktiviteter. De flesta vägar har redan publicerats. Några av de vägar som anges i detta övergripande schema stöds för närvarande endast av opublicerade data som kommer att publiceras inom kort.
NADPH-oxidaser och diabetisk njursjukdom
Diabetes resulterar i en minskad koppling mellan syreförbrukning och ATP-produktion vilket innebär att mer syre krävs för att producera samma mängd ATP. Detta missförhållande mellan syrekonsumtion och ATP-produktion drivs initialt av reglerad aktivering av mitokondriproteinet Uncoupling proten 2 (UCP-2). Detta är en protonbärare som translokerar protoner över det inre membranet i mitokondrierna förbi ATP-syntaset och orsakar därför minskad effektivitet. UCP-2 aktiveras direkt av superoxidradikaler. Behandling med antioxidanter har faktiskt visat sig förhindra aktivering av UCP-2 och därigenom förhindra protonläckage. Källan till superoxidradikaler som aktiverar UCP-2 vid diabetes kan involvera själva mitokondrierna eller vara resultatet av aktivering av NADPH-oxidas. NADPH-oxidas är enzymer som ansvarar för en reglerad produktion av superoxidradikaler och väteperoxid som krävs för normal cellsignalering. I njurarna finns isoformerna NADPH-oxidas 1, 2 och 4 (även isoform 5 hos människor). Vid diabetes aktiveras dessa enzymer vilket orsakar ökad produktion av superoxidradikaler. Det är dock för närvarande inte känt om det finns en direkt koppling mellan NADPH-oxidasaktivitet och UCP-2-medierat protonläckage. Det aktuella projektet undersöker en förmodad signalering mellan NADPH-oxidas och mitokondriereffektivitet, med användning av primär odling av njurepitelial proximala tubulära celler från vildtyps- och UCP-2 knockoutmöss. Nya NADPH-oxidashämmare och siRNA-medierad knockdown används för att modulera NADPH-oxidasaktivitet i isolerade celler följt av detaljerad utvärdering av syreförbrukningen med högupplöst respirometri.
Mitokondriers funktion vid njursjukdom
Oxidativ fosforylering är väsentlig för att tillhandahålla tillräcklig cellulär energi för att upprätthålla tubulär funktion och därmed hela kroppens homeostas. Vi har rapporterat förändrad mitokondriefunktion i den diabetiska njuren och vi undersöker nu dess samband med njursjukdom. Mitokondriell funktion och produktion av väteperoxid kan mätas i isolerade mitokondrier och permeabiliserade celler med hjälp av högupplöst respirometri. Detta utförs i Oroboros Oxygraph 2k genom att lägga till respiratoriska komplexspecifika substrat och inhibitorer för att undersöka de olika komplexens inneboende relativa och absoluta aktiviteter och även bestämma mitokondriell syreaffinitet, maximal frikopplad andning och effektivitet (P/O-förhållande) . P/O-förhållandet mäts genom steady state-infusion av ADP vid submaximal andning (Fig. 1.) som bättre återspeglar in vivo-situationen jämfört med den vanliga metoden genom att lägga till en bolusdos av ADP. Detta tillvägagångssätt tillåter oss också att undersöka ospecifikt och proteinmedierat protonläckage över det inre membranet. Fluorescensmodulen i Oxygraph 2k möjliggör samtidig detektering av mitokondriell väteperoxidproduktion under de olika tillstånden.
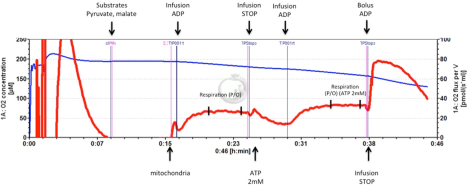
Mätning av mitokondriell P/O-kvot (±2 mmol/L ATP) genom att använda steady state-infusion av ADP vid submaximal andningshastighet. Blå linje: syrekoncentration i kammaren (vänster skala). Röd linje: syreförbrukning (höger skala). Infusion av ADP i närvaro av pyruvat och malat. En bolusdos av ADP tillsätts i slutet av experimentet för att bekräfta att andningen under ADP-infusionen var ungefär hälften av det maximala.
Intrarenal hyaluronan i regleringen av vätskebalansen. Patofysiologisk relevans för njurskada under diabetes och ischemi-reperfusion
Njuren är en huvudsaklig bestämningsfaktor för vätske-/elektrolytbalansen och för medelartärblodtrycket. Hypertoni orsakas ofta av en renal oförmåga att reglera vätskebalansen. Det aktuella forskningsförslaget fokuserar på en matriskomponent (hyaluronan, HA) med extrema vattenattraherande egenskaper i regleringen av vätskebalansen. Den proinflammatoriska egenskapen hos HA utvärderas också i patofysiologiska modeller. I motsats till njurbarken som nästan är tom på HA, innehåller njurmärgens interstitium höga mängder HA under normala fysiologiska tillstånd som förändras beroende på kroppens hydreringsstatus och, allvarligare, under patologiska tillstånd.
Vi har funnit att HA har en viktig dynamisk roll i normal njurvattenhantering (hydrering/dehydrering) och att den intrarenala fördelningen av HA är allvarligt förändrad under diabetes och efter ischemi-reperfusionsskada som korrelerar med njurdysfunktion och inflammation. Den normala intrarenala fördelningen av HA förändras också allvarligt om angiotensin II-tonus minskar neonatalt (under nefrogenes) hos råttan, vilket korrelerar med njurdysfunktion och inflammation.
Vi strävar efter att:
- bestämma den fysiologiska relevansen av glykosaminoglykanen hyaluronan (HA) vid regleringen av njurvätske/elektrolytbalansen;
- bestämma den patofysiologiska relevansen av HA i njurdysfunktion under diabetes (diabetisk nefropati) och efter ischemi-reperfusionsskada;
- fastställa om hyaluronidasbehandling och siRNA förbättrar njurfunktionen under diabetisk nefropati och efter njurischemi-reperfusion;
- belysa tidsramen och mekanismerna i utvecklingen av den intrarenala heterogena distributionen av HA som förekommer neonatalt hos råtta och dess angiotensin II-beroende.
Både in vivo och in vitro experiment utförs. Diabetes, ischemi, hydrering, uttorkning, hormoner, farmakologiska och biomolekylära ingrepp aktiverar/avaktiverar systemen. Human njurvävnad från resektioner analyseras också. Råttor och genetiskt modifierade möss används under in vivo-förhållanden, varefter njurvävnaden analyseras med användning av molekylärbiologi för att följa HA (mängd, storlek), HA-syntaser, hyaluronidaser och CD44-uttryck. Renomedullära interstitialceller i kultur används parallellt för att följa liknande parametrar under interventioner. I samarbete med sektionen för diagnostisk radiologi (prof Per Liss) ska mekanismerna bakom diabetisk nefropati valideras och den ökade känsligheten hos den diabetiska njuren för radiologiska kontrastmedel belysas. Hjärt- och kärlsjukdomar är en dominerande orsak till invaliditet och dödlighet. Resultaten av de pågående projekten kan ge upphov till grundläggande förståelse för och nya behandlingsformer för vätskebalansrubbningar och hjärt-kärlsjukdom.
Tekniker
Klassisk in vivo njurfysiologi och blodtrycksreglering i experimentella modeller av akut och kronisk njursjukdom.
Totalt njurblodflöde med hjälp av Transonic och regionalt njurblodflöde med laser-dopplerflödesmetri.
Helt icke-invasiv högupplöst magnetisk resonanstomografi av regionalt njurblodflöde och syresättning i experimentella modeller och människor.
Högupplöst respirometri med Oxygraph 2k utrustad med TIP2k och fluorescens LED2-modulen.
Trådmyografi för att studera mikrovaskulär funktion.
Primärodling av njurproximala tubulära epitelceller samt interstitiella celler från njurmärgen.
siRNA knockdown in vivo och in vitro.
Elektronparamagnetisk detektering av fria radikaler.
Publikationer
Ingår i American Journal of Physiology. Regulatory Integrative and Comparative Physiology, 2023
Dose-dependent regulation of kidney mitochondrial function by angiotensin II
Ingår i Upsala Journal of Medical Sciences, 2023
- DOI för Dose-dependent regulation of kidney mitochondrial function by angiotensin II
- Ladda ner fulltext (pdf) av Dose-dependent regulation of kidney mitochondrial function by angiotensin II
Renal mitochondrial dysfunction in ovine experimental sepsis-associated acute kidney injury
Ingår i American Journal of Physiology - Renal Physiology, s. 571-580, 2023
- DOI för Renal mitochondrial dysfunction in ovine experimental sepsis-associated acute kidney injury
- Ladda ner fulltext (pdf) av Renal mitochondrial dysfunction in ovine experimental sepsis-associated acute kidney injury
Ingår i Critical Care, 2022
- DOI för Decreased renal perfusion during acute kidney injury in critical COVID-19 assessed by magnetic resonance imaging: a prospective case control study
- Ladda ner fulltext (pdf) av Decreased renal perfusion during acute kidney injury in critical COVID-19 assessed by magnetic resonance imaging: a prospective case control study
Ingår i PLOS ONE, 2022
- DOI för Thyroid hormone increases oxygen metabolism causing intrarenal tissue hypoxia; a pathway to kidney disease
- Ladda ner fulltext (pdf) av Thyroid hormone increases oxygen metabolism causing intrarenal tissue hypoxia; a pathway to kidney disease
Ingår i eLIFE, 2022
- DOI för Repression of hypoxia-inducible factor-1 contributes to increased mitochondrial reactive oxygen species production in diabetes
- Ladda ner fulltext (pdf) av Repression of hypoxia-inducible factor-1 contributes to increased mitochondrial reactive oxygen species production in diabetes
Mitochondrial Respiration-Dependent ANT2-UCP2 Interaction
Ingår i Frontiers in Physiology, 2022
- DOI för Mitochondrial Respiration-Dependent ANT2-UCP2 Interaction
- Ladda ner fulltext (pdf) av Mitochondrial Respiration-Dependent ANT2-UCP2 Interaction
Ingår i Acta Physiologica, 2021
- DOI för Pharmacological HIF-PHD inhibition reduces renovascular resistance and increases glomerular filtration by stimulating nitric oxide generation
- Ladda ner fulltext (pdf) av Pharmacological HIF-PHD inhibition reduces renovascular resistance and increases glomerular filtration by stimulating nitric oxide generation
Ingår i Clinical Science, s. 2243-2263, 2021
A model of mitochondrial O-2 consumption and ATP generation in rat proximal tubule cells
Ingår i American Journal of Physiology - Renal Physiology, 2020
Ingår i Journal of Physiology, s. 5573-5587, 2020
- DOI för Determinants of renal oxygen metabolism during low Na+ diet: effect of angiotensin II AT1 and aldosterone receptor blockade
- Ladda ner fulltext (pdf) av Determinants of renal oxygen metabolism during low Na+ diet: effect of angiotensin II AT1 and aldosterone receptor blockade
Ingår i American Journal of Physiology - Renal Physiology, 2020
Intrarenal oxygenation determines kidney function during the recovery from an ischemic insult
Ingår i American Journal of Physiology - Renal Physiology, 2020
Erik Persson (1941-2020): a Remembrance
Ingår i Acta Physiologica, 2020
Ingår i Diabetes/Metabolism Research Reviews, 2019
Ingår i Acta Physiologica, 2019
Metabolite aberrations in early diabetes detected in rat kidney using mass spectrometry imaging
Ingår i Analytical and Bioanalytical Chemistry, s. 2809-2816, 2019
- DOI för Metabolite aberrations in early diabetes detected in rat kidney using mass spectrometry imaging
- Ladda ner fulltext (pdf) av Metabolite aberrations in early diabetes detected in rat kidney using mass spectrometry imaging
Ingår i Tomography, s. 239-247, 2019
- DOI för High Intrarenal Lactate Production Inhibits the Renal Pseudohypoxic Response to Acutely Induced Hypoxia in Diabetes
- Ladda ner fulltext (pdf) av High Intrarenal Lactate Production Inhibits the Renal Pseudohypoxic Response to Acutely Induced Hypoxia in Diabetes
Ingår i American Journal of Physiology - Renal Physiology, 2019
Role of carbonic anhydrase in acute recovery following renal ischemia reperfusion injury
Ingår i PLOS ONE, 2019
- DOI för Role of carbonic anhydrase in acute recovery following renal ischemia reperfusion injury
- Ladda ner fulltext (pdf) av Role of carbonic anhydrase in acute recovery following renal ischemia reperfusion injury
Acute renal metabolic effect of metformin assessed with hyperpolarised MRI in rats
Ingår i Diabetologia, s. 445-454, 2018
Ingår i American Journal of Physiology - Renal Physiology, 2018
Ingår i Acta Physiologica, 2018
The effect of inactin on kidney mitochondrial function and production of reactive oxygen species
Ingår i PLOS ONE, 2018
- DOI för The effect of inactin on kidney mitochondrial function and production of reactive oxygen species
- Ladda ner fulltext (pdf) av The effect of inactin on kidney mitochondrial function and production of reactive oxygen species
Ingår i American Journal of Physiology - Renal Physiology, 2018
Editorial: Hypoxia in Kidney Disease
Ingår i Frontiers in Physiology, 2018
- DOI för Editorial: Hypoxia in Kidney Disease
- Ladda ner fulltext (pdf) av Editorial: Hypoxia in Kidney Disease
Ingår i Mediators of Inflammation, 2017
- DOI för 15-Deoxy-Delta(12,14)-prostaglandin J(2) Exerts Antioxidant Effects While Exacerbating Inflammation in Mice Subjected to Ureteral Obstruction
- Ladda ner fulltext (pdf) av 15-Deoxy-Delta(12,14)-prostaglandin J(2) Exerts Antioxidant Effects While Exacerbating Inflammation in Mice Subjected to Ureteral Obstruction
Antioxidant treatment attenuates lactate production in diabetic nephropathy
Ingår i American Journal of Physiology - Renal Physiology, 2017
Ingår i Magnetic Resonance in Medicine, s. 457-461, 2017
Ingår i American Journal of Physiology - Renal Physiology, 2017
Hypoxia-inducible factor activation in diabetic kidney disease.
Ingår i Current opinion in nephrology and hypertension, s. 345-350, 2017
Metformin Normalises Medullary Hypoxia in The Diabetic Rat Kidney
Ingår i The FASEB Journal, 2017
Role of carbonic anhydrase in acute recovery following renal ischemia reperfusion injury
Ingår i The FASEB Journal, 2017
Ingår i International Journal of Molecular Sciences, 2017
Pronounced kidney hypoxia precedes albuminuria in type 1 diabetic mice
Ingår i AMERICAN JOURNAL OF PHYSIOLOGY-RENAL PHYSIOLOGY, 2016
Ingår i Journal of Hypertension, s. 833-835, 2016
Ingår i Upsala Journal of Medical Sciences, s. 12-16, 2016
- DOI för Iodinated contrast media inhibit oxygen consumption in freshly isolated proximal tubular cells from elderly humans and diabetic rats: Influence of nitric oxide.
- Ladda ner fulltext (pdf) av Iodinated contrast media inhibit oxygen consumption in freshly isolated proximal tubular cells from elderly humans and diabetic rats: Influence of nitric oxide.
Pancreatic islet blood flow and its measurement
Ingår i Upsala Journal of Medical Sciences, s. 81-95, 2016
- DOI för Pancreatic islet blood flow and its measurement
- Ladda ner fulltext (pdf) av Pancreatic islet blood flow and its measurement
Renal oxygenation during haemorrhage is not aggravated by angiotensin II AT1-receptor blockade
Ingår i Acta Physiologica, s. 153-155, 2016
Ingår i The FASEB Journal, 2015
Ingår i Diabetologia, s. 2435-2442, 2015
Ingår i Microvascular Research, s. 124-129, 2015
- DOI för The use of hydrogen gas clearance for blood flow measurements in single endogenous and transplanted pancreatic islets
- Ladda ner fulltext (pdf) av The use of hydrogen gas clearance for blood flow measurements in single endogenous and transplanted pancreatic islets
Activation of Hypoxia-Inducible Factors Prevents Diabetic Nephropathy
Ingår i Journal of the American Society of Nephrology, s. 328-338, 2015
Ingår i Acta Physiologica, s. 58-58, 2015
Ingår i American Journal of Physiology - Renal Physiology, 2015
Ingår i Acta Physiologica, s. 311-318, 2015
ET-1 increases reactive oxygen species in hypoxic glomeruli during high salt intake
Ingår i Acta Physiologica, s. 559-560, 2015
Ingår i Acta Physiologica, s. 795-804, 2015
Ingår i Kidney International, s. 109-115, 2015
Ingår i Upsala Journal of Medical Sciences, s. 233-240, 2015

